Grupos funcionales (Nomenclatura de amidas)
El acoplamiento directo entre un ácido carboxílico y una amina difícilmente sea una opción adecuada en la química sintética debido al intercambio de protones de ácido/base que compiten. La estrategia más frecuente es la conversión del ácido a una forma activada (es decir, más electrófila) como el cloruro o el anhídrido de acilo. Estas especies reaccionan inmediatamente con las aminas primarias y secundarias y producen la amida correspondiente.
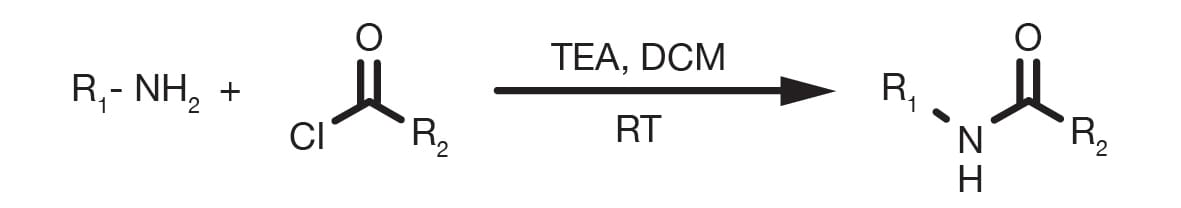
La acilación de aminas mediante cloruro de acilo suele denominarse reacción de Schotten-Baumann, nombre que proviene de sus inventores. Con mayor frecuencia, la reacción comienza rápidamente a temperatura ambiente en disolventes apróticos en presencia de una base adecuada, como por ejemplo, aminas terciarias o piridina. A menudo, se añade una solución acuosa de la base en gotas, que finalmente genera un sistema bifásico. La reacción de Schotten-Baumann y el acoplamiento entre la amina y un anhídrido están mecánicamente relacionados, la única diferencia significativa es el producto derivado del ácido: ácido clorhídrico (HCl) en un caso, un ácido carboxílico en el otro. Ambos requieren una base para dirigir el equilibrio hacia la derecha.
La preparación del cloruro de acilo puede llevarse a cabo in situ mezclando el ácido carboxílico con cloruro de tionilo o cloruro de oxalilo en disolventes apróticos como DCM, THF, o acetato de etilo. Al someter la mezcla a reflujo durante algunas horas, suelen obtenerse conversiones correctas. Es necesario aislar el cloruro de acilo antes de realizar el paso de amidación con la amina.
Dos de los reactivos más frecuentes de este grupo son diclohexilcarbodiimida (DCC), diisopropilcarbodiimida (DIC) y 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDC). Estos reactivos reaccionan con ácidos carbonílicos para formar una O-acilisourea altamente reactiva que se puede convertir en una amida mediante la reacción con una amina, con alta productividad y tiempos cortos de reacción.
La síntesis de O-acilisoureas se ve beneficiada por el uso de disolventes apolares cuando sea posible (p. ej., DCM), aunque se pueden usar muchos disolventes apróticos apolares.
Las O-acilisoureas se encuentran entre los intermediarios más activos para el acoplamiento de las amidas; sin embargo, pueden racemizarse espontáneamente. Esto debe tenerse en cuenta en la estrategia sintética.
Este también es el motivo por el cual en la síntesis péptida la activación del ácido carboxílico suele realizase en presencia de aditivos de hidroxibenzotriazol que reaccionan rápidamente con el éster activado. En este caso, el paso de activación debe describirse mejor como una activación de DCC/hidroxibenzotriazol de dos pasos.
Este segundo paso de reacción genera otro éster activado que no se racemiza, sino que retiene un nivel suficiente de activación para un acoplamiento eficiente de los péptidos.
Los triazoles más frecuentes para esta aplicación son 1-hydroxy-benzotriazole (HOBt), y 1-hidroxi-7-aza-benzotriazol (HOAt).

Edgar Cabanzo garcia le está invitando a una reunión de Zoom programada.
Tema: Sala de reuniones personales de Edgar Cabanzo garcia
Unirse a la reunión Zoom
https://us04web.zoom.us/j/6808376444?pwd=UWlGd1NCc3hhVS85aU1KUFpXem4wQT09
ID de reunión: 680 837 6444
Contraseña: 7pmJyk


Comments
Post a Comment